ちなみに、「銅から緑青ができる化学反応式を書け」と言われたら? まず、左辺に銅、右辺に緑青の化学式を書きます。 cu →cuco 3 ・cu (oh) 2 次は? 大気中に含まれる、反応性の高い気体はなんでしょう? o 2,co 2, そしてh 2 o(水蒸気) · 1 回答 使い捨てカイロの反応式について 使い捨てカイロの反応式について 使い捨てカイロの反応式を調べているのですが、 Fe3/4O23/2H2O→Fe (OH)3・・・① 2FeO2→2FeO・・・② 2Fe3/2O2→Fe2O3・・・③ などいろいろ出てきました。 とあるサイトでは鉄の酸化は多岐にわたるので、どれが進行するか特定はできない、と書かれ、また別のサイトでは、②ではなく①安心の日本製☆ 使い捨てカイロ のように廃棄物が発生せず"繰り返し使用"できる、環境に優しい携帯 カイロ !ZIPPO オイル 化学発熱 充填式 カイロ ジッポ ハンディーウォーマー セット ZHW15 ハンディウォーマー 通販 Yahoo!ショッピング

中2理科 化学変化と温度変化 練習編1 映像授業のtry It トライイット
カイロ 化学 反応 式
カイロ 化学 反応 式- · 銀鏡反応実験のやり方 まずは、一般的な化学実験で行われます銀鏡反応のやり方についてお話します。 私も大学時代のサークルで展示物を出す際に、ガラスに銀鏡反応させて銀メッキをした経験がありますが、実際に実験に携わって、きちんとアルデヒドの検出反応について理解する事がQ1 2co + o 2 → 2co 2 の化学反応式で表される化学反応において、 2.0lの一酸化炭素と1.0 lの酸素が反応すると、何lの二酸化炭素が
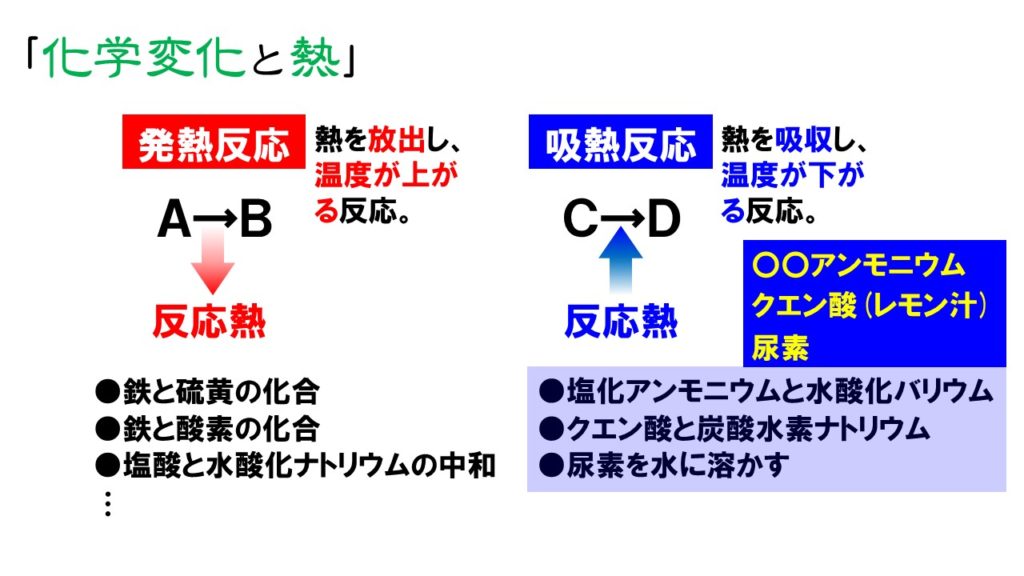


中2理科 化学反応と熱 発熱反応と吸熱反応 Pikuu
· この実験の化学反応式は 鉄 + 酸素 → 酸化鉄 と覚えておけばよいです。詳しい反応式は高校生以降で学習します。 ② マグネシウムの燃焼 マグネシウムリボン(マグネシウムのこと)を加熱すると燃焼がおこり、 酸化マグネシウム ができる。 酸化マグネシウムの化学式は MgO3 化学反応式 1) 炭素の酸化 次の手順で説明するとよい ・ ダイヤモンドと炭素は同じ ・ 火事になるとダイヤはどうなるか? ・ 『酸化』だから何と化合するか? ・ 酸素はOか?O2か? · 娘の試験問題を見たところ、使い捨てカイロの実験が問題に出ていました。 高温加熱による鉄の酸化の化学反応式は 2Fe O2 → 2FeO(黒色) 熱 と中学では習います。 (実は鉄の高温酸化反応でできる生成物は、酸化第二鉄Fe2O3、四酸化三鉄Fe3O4が主のようです。
この時の反応を化学反応式で表すと、 2Mg + CO 2 → 2MgO + C となります。ると温かくなる「携帯用カイロ」をどのようにとらえてい るのでしょうか? 携帯用カイロの外袋を見てみると、このように表記さ れています。 実は、携帯用カイロは鉄が酸素と結びつく「酸化」という 化学変化が起こる際に出る熱を利用したものです。この式で,185kJは,水素と塩素各1molが反応して塩化水素2molを生じたときの反応熱であり,反応熱の符号が+だから発熱反応になる。 符号がもし-なら吸熱反応となる。 より一般的には,次のように表される。 H2(気)+Cl2(気) 2HCl(気) DH=-185kJ ここで,エンタルピー変化DHの符号が熱化学方程式の符号と逆であることに注意する。 熱化学方程式では,一般に物質をmol
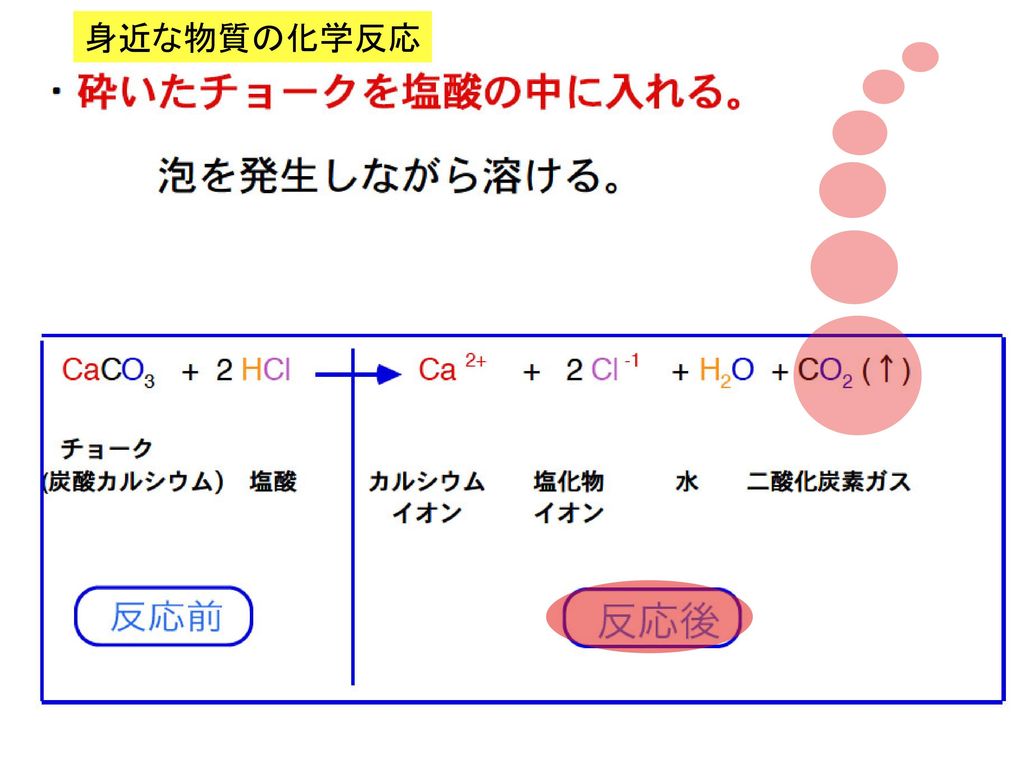
まずは上の式から確認しましょう。 銅+硫黄→硫化銅 と書いてありますね。 銅に硫黄を足したら硫化銅になったという意味ですね。 さらに、原子の種類を表した記号を使ってみましょう。 銅はCu、硫黄はSで表します。 出来上がる硫化銅はCuSですね。 つまり、 CuS→CuS となるわけです。 このように、記号だけで化学反応を表した式を 化学反応式 と言います実はカイロの中では化学変化が起きているのです。 カイロの原理を調べるため、次の図のような実験をしてみましょう。 ビーカーの中に 鉄 の粉が入っていますね。 それをガラス棒でかき混ぜているわけです。 鉄を空気中に置いておくと、空気中の酸素がくっついて酸化鉄ができますね。 実は、このように鉄が酸化鉄になるときには、周りに熱が発生しているの · カイロの化学反応式を調べると、このような物が出てきたのですが、どうしてこのような化学反応式になるのか分かりやすく教えてください。 左右の係数が揃っていないように思うのですが Fe 3/4O23/2H2O→Fe(


第31章 反応熱



実験8 9発熱反応 吸熱反応の導入について ラスカルのブログ
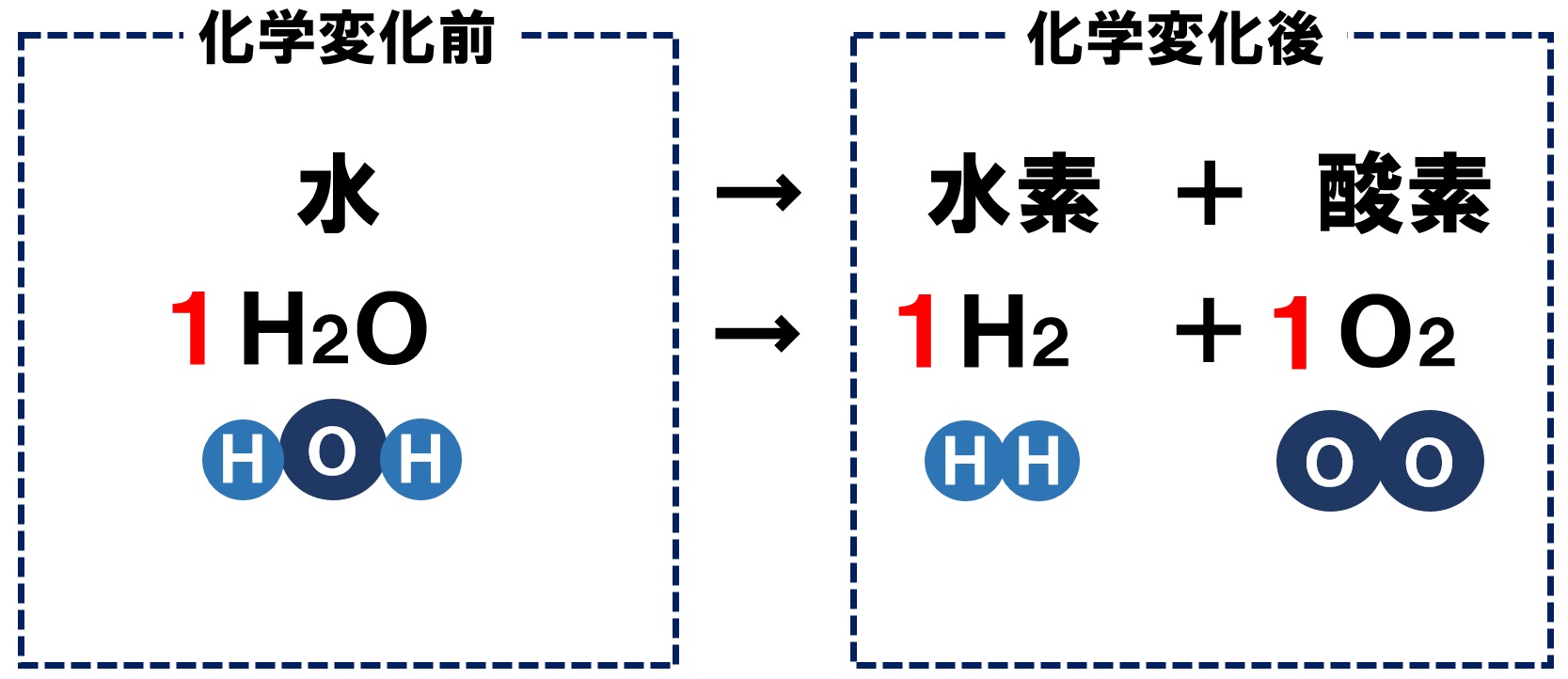
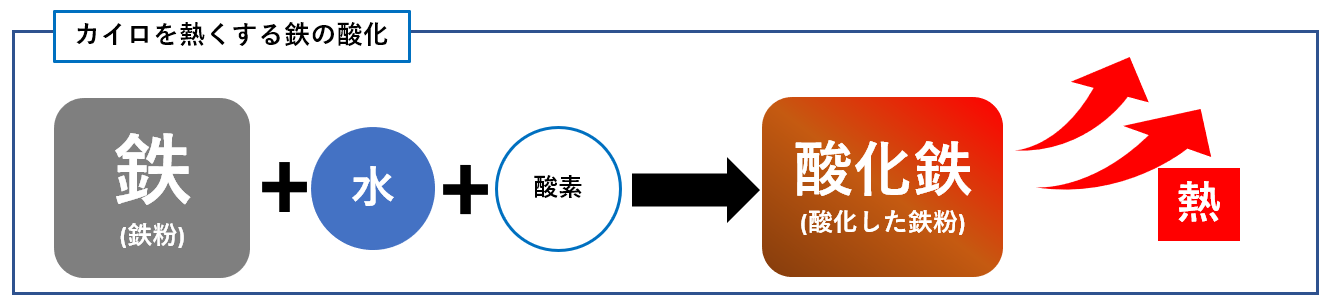
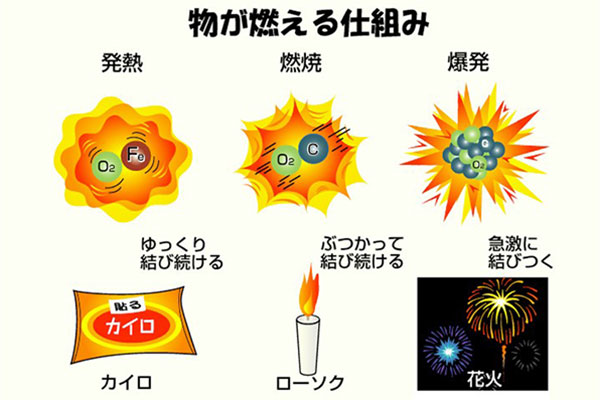
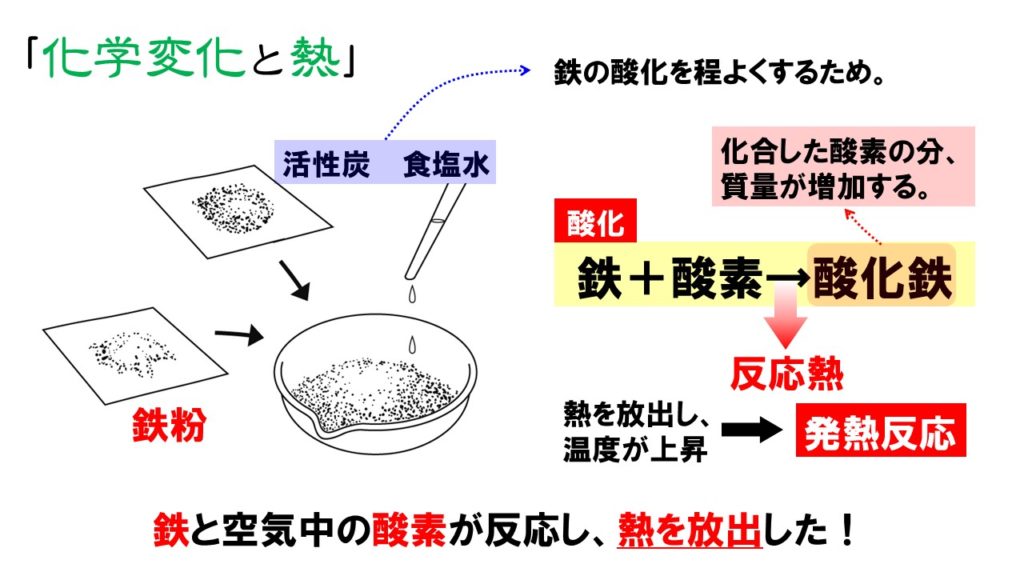
2 化学反応式 か 化学変化を粒子で考える 例)水 h 2 o を分解すると水素 h 2 と酸素 o 2 になる。 このままでは何かがおかしい。何がおかしいのか考えてみよう。 (ヒント:原子の性質の 1 つ「原子は新しくできたり,消滅したりしない」) 分解する前と後で o 原子の数が合っていない。ベンジン1 cc 当り約11,500 cal (≒48,116 J )と、使い捨てカイロの約13倍の熱量を持ちながら、機種により差はあるがおよそ燃料1ccで、表面温度60度の状態を約1 2時間保持可能。 反応開始時、130度以上の触媒加熱が必要で、炎または電熱線を用いた加熱が一般的。 なお、ベンジン等可燃性物質の航空機内持ち込みは法令による禁止行為のため、ベンジンを使った · 化学カイロ 鉄+酸素→酸化鉄+ 反応熱 化学カイロの中の鉄粉が空気中の酸素と化合するときに、熱が放出され温度が上昇します。反応後の酸化鉄は、化合した酸素の分だけ質量が増加しています。 化学カイロ 化学カイロの中に見ついて調べる実験を行った。次の各問いに答えよ。 (1)化学



使い捨てカイロを作ってみよう おもしろ科学実験室 工学のふしぎな世界 国立大学56工学系学部hp



Amazon ラウンドハンディウォーマー Mg Trail 冷え性対策に繰り返し使えるエコカイロ最長24時間ぽかぽか持続 ゴールド Mg Trail 使い捨てカイロ
化学変化 化学反応式 塩化銅→銅+塩素 CuCl2→Cu+Cl2 塩酸→水素+塩素 2HCl→H2+Cl2 塩化ナトリウム→ナトリウム+塩素 2NaCl→2Na+Cl2 酸化銀→銀+酸素 2Ag2O→4Ag+O2 炭酸水素ナトリウム →炭酸ナトリウム+二酸化炭素+水 2NaHCO3→Na2CO3+CO2+H2O 水→水素+酸素 2H2O→2H2+O2 化合 · 酸化 さんか ( 燃焼 ねんしょう )の化学反応式 一覧 酸化とは:物質が酸素と化合すること。酸化の中でも、熱や光を発しながら激しく酸化することを燃焼という。 水素の燃焼(水の合成) 2h 2 o 2 → 2h 2 o 水素が酸化して水になる。 炭素の完全燃焼 c o 2 → co 2 炭素が酸化して二次の化学反応により鉄と等量の水素が気体として発生する Fe +2HCl→FeCl2 +H2 (1) ( ) RT p p V n H O gas H 2 2 − = 理想気体の状態方程式 を仮定する。(PV=nRT) = 2 ×100 Fe W n Ratio Fe H 未反応の鉄含有率(%) 未反応の鉄の物質量 化学カイロに用いた鉄の物質量



短時間だけ使用したカイロを再使用する方法 理化学ラボーブログ


実験6 使い捨てカイロ おだやかな酸化 2年理科 化学 Takaの授業記録03
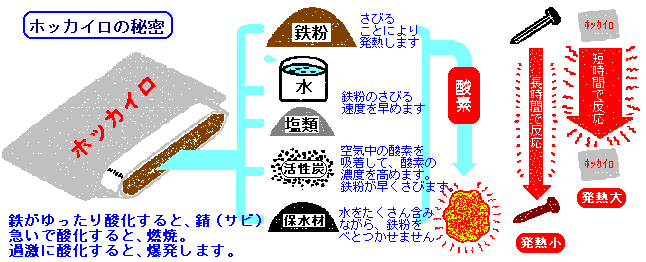
しかし,その前に必要なものがあります。それは化学反応式が正しくかけるということです。この章は,化学反応式と化学反応の量的関係についての勉強です。 この章の学習内容は,次の通りです。 (1)化学反応式 (2)イオン反応式 (3)モル濃度 · 化学変化と熱(千葉県教育委員会)化学反応における熱の出入りを扱う実験では,化学カイロの成分である鉄の酸化反応を用いるのが一般的である。鉄粉と活性炭に食塩水があれば 10 分程度で鉄が酸化し,熱が発生する実験であり,原理は簡易なものである。測定した温度変化をグラフに表すと,鉄の酸化が発熱反応であることが実感できる。また,温度が · 高校の授業でカイロを作る実験がありました。 まず、最初に鉄と活性炭を混ぜて温度の変化を記録しました。 次に、鉄と活性炭と食塩水、その次に鉄と食塩水を混ぜて温度の変化を記録しました。 レポートでこのときの化学反応式を書けという質問がでているのですが 調べても 2FeO2→2FeO という反応式しか見つかりません FeCの場合、FeCNaCl aqの場合、Fe



科学実験 使い捨てカイロのしくみ あっとほうむ Youtube


カイロ工業会ホームページ
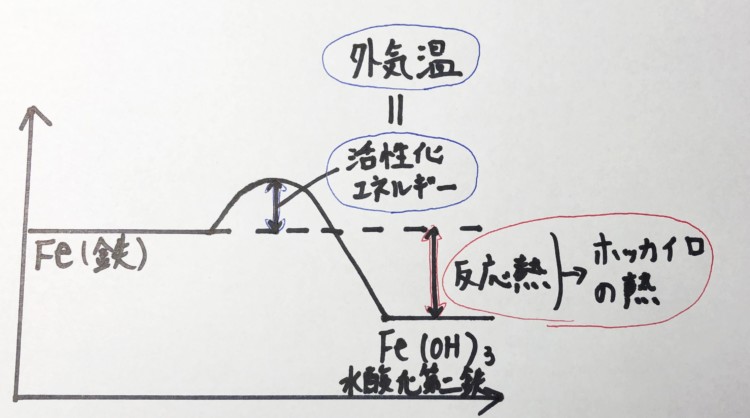
4Fe 2H 2O 3O 2 → 4FeOOH この反応は発熱反応である。図4 に,化学カイロ中での 鉄の酸化反応による鉄粉表面の変化を示す。市販の化学 カイロでは酸素供給 化学 酸化アルミニウム(Al2O3)のHClおよびNaOHとの反応式を探しているのですがなかなか見つかりません。どのような反応をするの · ハクキンカイロの原理可燃性オイル(ベンジン)と白金(プラチナ)触媒反応です。となれば化学式を書くしかありませんね。ベンジンはc6h14です。c6h14 17/2 o2 → 6co2 7h2oベンジンと酸素が反応して二酸化炭素と水を生成します。この化学反応時に熱を発しますので、これによって温まそれから、使い捨てカイロの化学反応式は、 2Fe+ O 2 → 2FeO+ 熱エネルギー ではなく、 Fe+ 3/4O 2 + 3/2H 2 O→ Fe(OH) 3 + 熱エネルギー です。



カイロはどうして温かくなるの 酸化反応 の原理を解説


Qrコード
化学変化 問題 チェックテスト 原子・分子 化学反応式 分解・化合 酸化・還元・化学エネルギー 基本問題 原子・分子 化学反応式 酸化・還元、化学変化と熱 酸化と還元2 硫黄と鉄の反応 化学変化と実験1 化学変化と実験2 化学変化と実験3 化学変化と質量化学反応を使うカイロの比較 化学反応を使うタイプは温度の公称値が、未記載のものが多いため、十分な比較ができませんでした。 いくつか代表的なものを紹介します。 エス・アンド・エス カイロ 何度も使えるエコカイロ 031 posted with カエレバ エス・アンド・エス Amazon クルトしたがって,1gの水の温度を1℃上昇させるのに必要な熱量は,Q=4.2×1×1=4.2〔J〕となりますね。 4.2Jは1calと等しい熱量です。 1Jは約0.24calです。 次は,反応熱です。 携帯用カイロは,鉄の酸化による発熱を利用しています。 また,生石灰CaOと水の反応を利用した,加熱器具を使わないでも温まる弁当などもあります。 一方,硝酸アンモニウムNH4NO3などが水



実験8 9発熱反応と吸熱反応のまとめ ラスカルのブログ



中2 理科 化学変化 中学生 理科のノート Clear
化学反応式の例 酸化銀の分解 2Ag 2 O → 4Ag O 2 炭酸水素ナトリウムの分解 2NaHCO 3 → Na 2 CO 3 CO 2 H 2 O 水の分解 2H 2 O → 2H 2 O 2 塩化銅の分解 CuCl 2 → Cu Cl 2 銅の酸化 2Cu O 2 → 2CuO マグネシウムの酸化 2Mg O 2 → 2MgO 炭素の酸化 C O 2 → CO 2 水素の燃焼 2H 2 O 2 → 2H 2 O 鉄と硫黄の化合 Fe S物質量と化学反応式 ろ過 アルコール爆発 ろ過と吸着 分子量の測定 蒸発 化学反応の量的関係 蒸留 ヘスの法則 サインペンの ペーパークロマトグラフィー 炎色反応 物質の三態 紫キャベツからの色素の抽出 融解熱、蒸発熱 ヨー素の昇華 アイス化学反応式41ハロゲンイオンとハロゲン分子の反応 \2KBr Cl_{2} → 2KCl Br_{2} \ 酸化力のより強いハロゲン分子は酸化力が弱いハロゲンイオンから電子e – を奪い取りハロゲンイオンとなる。 ※ハロゲンについて詳しくはハロゲン単体・ハロゲン化水素の性質・製法を参照 化学反応式42



中学2理科 化学変化と原子分子 Clear
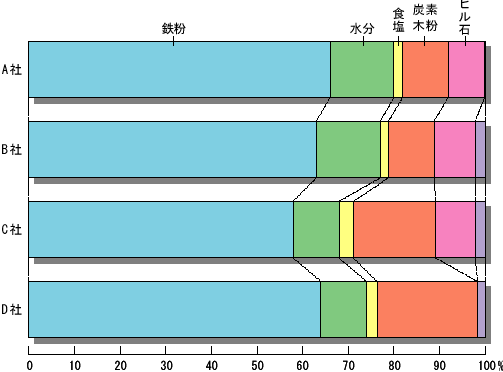


課題研究の指導 理科
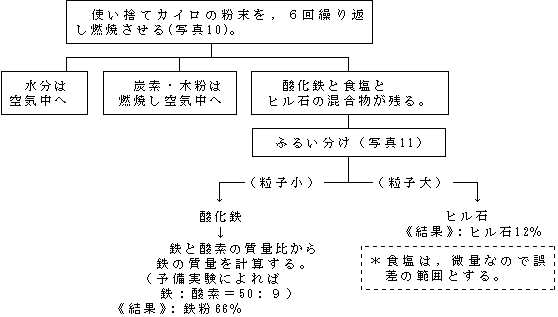


課題研究の指導 理科



中2 理科 化学変化 中学生 理科のノート Clear



アニメ ゆるキャン に登場したカイロをイメージした ゆるキャン ハンディカイロ ちくわver で実際に温まってみた Gigazine



カイロのすべて カイロのしくみ 桐灰カイロ 小林製薬



カイロを暖かいまま捨てると発火の危険あり 使い捨てカイロの中身が出ただけでも危険なのか 破れた場合など 途中で捨てる ウルトラフリーダム


鉄粉と活性炭 食塩水を混ぜた発熱反応 勉強ナビゲーター



鉄が燃焼し酸化鉄となるときの燃焼熱の計算問題をといてみよう 金属の燃焼熱
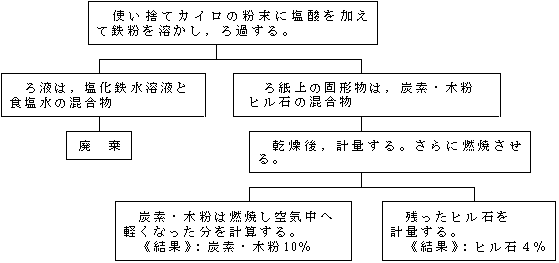


課題研究の指導 理科


実験6 使い捨てカイロ おだやかな酸化 2年理科 化学 Takaの授業記録03



中2理科 化学変化と温度変化 練習編1 映像授業のtry It トライイット


第1章 はじめに 1 自然とはなにか 2 自然科学とは 3 化学とは Ppt Download



身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾


カイロ工業会ホームページ


実験6 使い捨てカイロ おだやかな酸化 2年理科 化学 Takaの授業記録03


アルミホイルでカイロを作る



身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾


化学変化 化合 のまとめ 2年理科 化学 Takaの授業記録03


化学カイロ に関するq A Yahoo 知恵袋



Woa1 使い捨てカイロ外袋用多層フィルム及び使い捨てカイロ Google Patents



カイロはどうして温かくなるの 酸化反応 の原理を解説


実験6 使い捨てカイロ おだやかな酸化 2年理科 化学 Takaの授業記録03



中2 理科 化学変化 中学生 理科のノート Clear
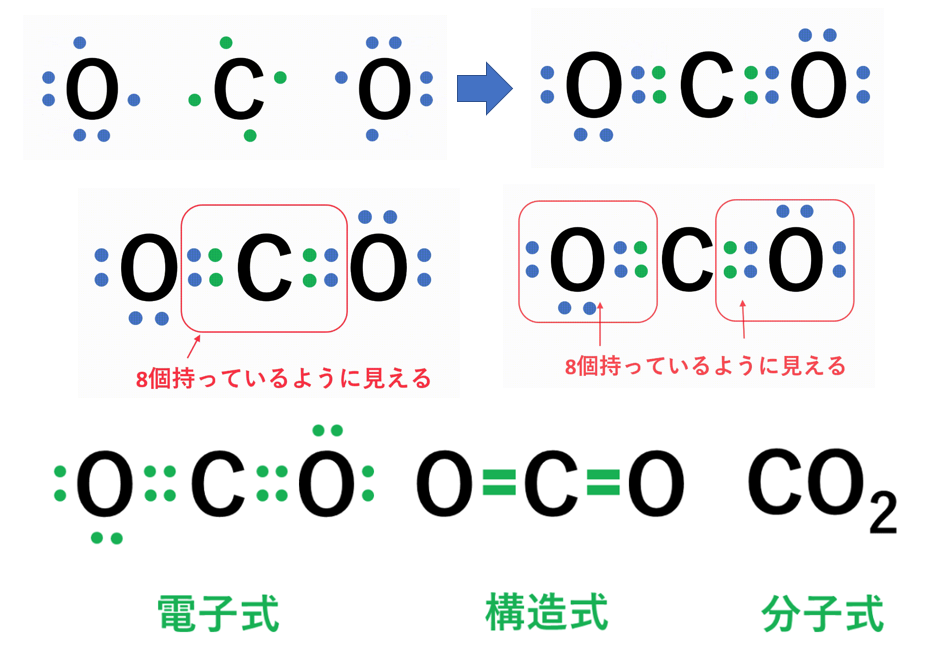


酸化鉄 化学反応式 中2



最新 中身も確認 高校化学を学ぶおすすめ本 社会人からでも 受験生基礎にも最適 Next Topic
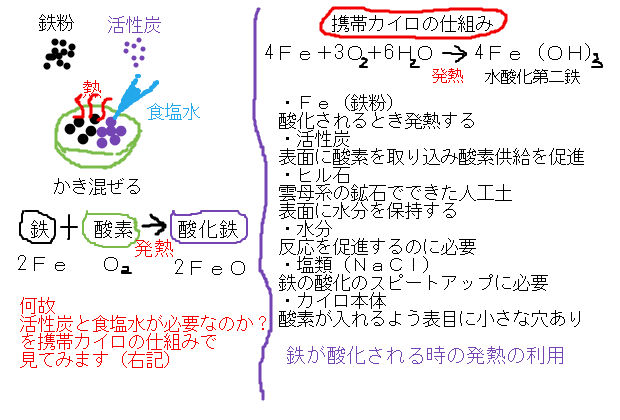


発熱反応と吸熱反応 中学数学 理科 寺子屋塾の復習サイト
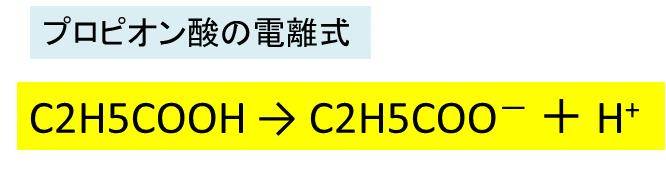


プロピオン酸の構造式 化学式 分子量は プロピオン酸の電離の反応式は



中2理科 化学変化と温度変化 練習編1 映像授業のtry It トライイット



夕凪亭別館 写真館 化学反応と熱



カイロのすべて カイロのしくみ 桐灰カイロ 小林製薬


実験6 使い捨てカイロ おだやかな酸化 2年理科 化学 Takaの授業記録03


鉄の酸化反応 使い捨てカイロの科学 日本の科学と技術日本の科学と技術



第1章 はじめに 1 自然とはなにか 2 自然科学とは 3 化学とは Ppt Download



最新 酸化 化学式 りんご 酸化 化学式 Joskabegamizcqh
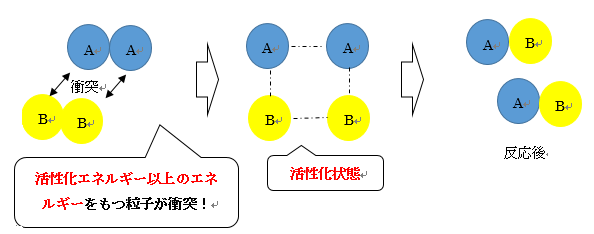


反応速度式とは 計算方法や求め方のなぜをわかりやすくグラフで解説 温度 濃度 係数 単位の覚え方 高校化学



中2理科 発熱反応と吸熱反応のポイント Examee



カイロのすべて カイロのしくみ 桐灰カイロ 小林製薬



ม 2 โน ตของ 中2 理科 身近な化学変化 ช น Junior Clear



最強カイロ決定戦 充電式 オイル式 使い捨て 温かさを徹底検証 価格 Comマガジン
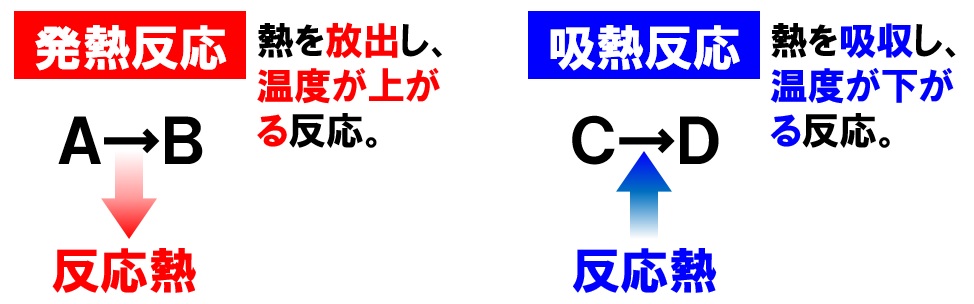


中2理科 発熱反応と吸熱反応のポイント Examee


実験おもしろ 14



化学反応式の作り方や覚え方 中学生でも簡単に書ける方法 三重の個人契約家庭教師



カイロのすべて カイロのしくみ 桐灰カイロ 小林製薬



カイロ3タイプ徹底比較 使い捨て 繰り返し使えるusb充電 化学反応エコカイロ編 Nicoa



この問題で左辺だけ分子式で書かれてて右辺が示性式になってるのはなん 化学 教えて Goo


酸化鉄 化学反応式 中2



夕凪亭別館 写真館 化学反応と熱


カイロ工業会ホームページ



中2理科 化学反応と熱 発熱反応と吸熱反応 Pikuu



本当はおもしろい化学反応 漂白剤の白さや混ぜると危険な理由など身近な化学反応の秘密がわかる の通販 齋藤 勝裕 サイエンス アイ新書 紙の本 Honto本の通販ストア



受験 中2復習 化学変化のキホン 中学生 理科のノート Clear


カイロが冷たい 発泡スチロール内でカイロが暖かいままにするには だんごむし


カイロ 脱酸素剤用途での鉄粉 Kobelco 神戸製鋼



キャンプでもバイクでも使えるハクキンカイロ最強説 No 4は眠らない



カイロはどうして温かくなるの 酸化反応 の原理を解説


理科2ページ目 三重の個人契約家庭教師


使い捨てカイロを作ってみよう おもしろ科学実験室 工学のふしぎな世界 国立大学56工学系学部hp



Amazon Srt ハンディウォーマー オイル充填式カイロ 釣り ゴルフ スポーツ観戦に 13時間継続 エコカイロ 標準セット 4 Sr Tools スポーツ アウトドア


実験6 使い捨てカイロ おだやかな酸化 2年理科 化学 Takaの授業記録03



酸化鉄 化学反応式 中2



反応熱の計算 生成熱 燃焼熱 溶解熱 中和熱 結合エネルギー 理系ラボ
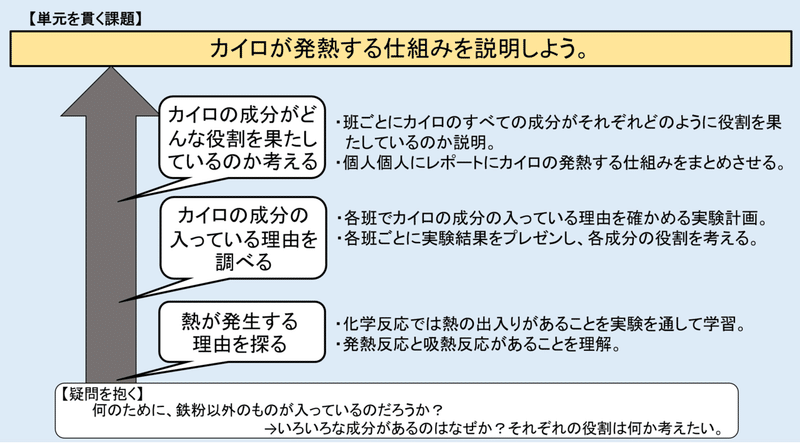


中学校理科 カイロの仕組みを説明しよう あるのすけ Note


第1章 はじめに 1 自然とはなにか 2 自然科学とは 3 化学とは Ppt Download



Clear 勉強ノートまとめアプリ Clearnotebooks こんにちは 新学期になって私の大学はコロナ以降初めて対面授業が始まりました 今日紹介するのは テ対 まとめました 中2理科復習 かほん アカ移行さんのノート 理科 中2 勉強垢始めました



温かさ長持ち Zippoブランドのオイル式カイロ 今日のライフハックツール ライフハッカー 日本版


使い捨てカイロの反応式について 使い捨てカイロの反応式を調べてい Yahoo 知恵袋


化学変化 化合 のまとめ 2年理科 化学 Takaの授業記録03


実験4 使い捨てカイロ 2年理科 化学 Takaの授業記録00



中2理科 化学反応と熱 発熱反応と吸熱反応 Pikuu



化学反応式の作り方のコツを教えてください Clear


中2理科 化学反応と熱 発熱反応と吸熱反応 Pikuu


酸化鉄 化学反応式 中2



反応熱の計算 生成熱 燃焼熱 溶解熱 中和熱 結合エネルギー 理系ラボ



カイロのすべて カイロのしくみ 桐灰カイロ 小林製薬


実験1 いろいろな酸化 3年理科 化学 Takaの授業記録04



ハクキンカイロmini エビスベンジン500mlセット オイルカイロ 携帯用 初心者セット ライフスタイル 生活雑貨のmofu 通販 Paypayモール
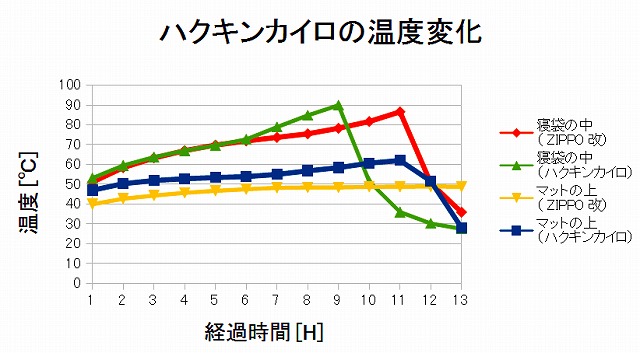


実験 寝袋にハクキンカイロとzippoカイロ 改 を入れた時の温度変化はどうなる 寝袋 シュラフのプロが極秘で教える 失敗しない選び方 使い方



ハクキンカイロについて カイロ 懐炉 スキー スノーボード アウトドア ハクキン 白金


第31章 反応熱



酸化鉄 化学反応式



中2理科 発熱反応 映像授業のtry It トライイット


初めて発売したのはあのお菓子メーカー あったかぬくぬくな 使い捨てカイロ の


実験6 使い捨てカイロ おだやかな酸化 2年理科 化学 Takaの授業記録03


